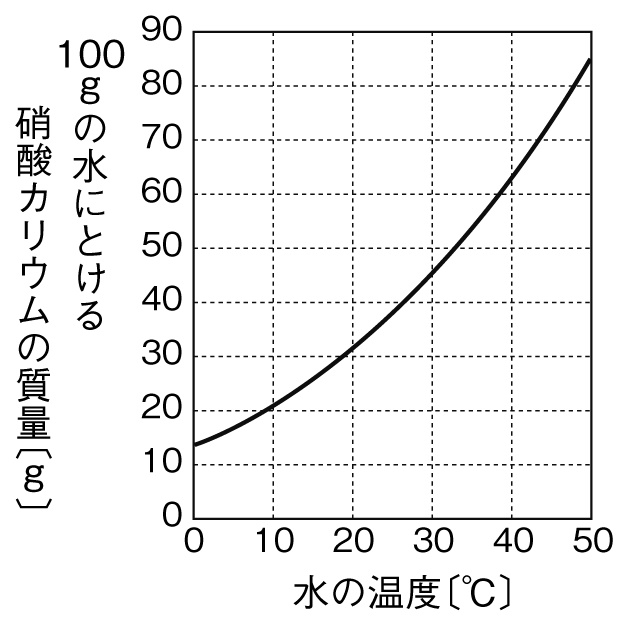
1.質量パーセント濃度とは、どのような濃度か? 2.モル濃度とは、どのような濃度か? 3.質量パーセント濃度が分かっている溶液のモル濃度を求める手順はどうだったか? お疲れさまでした。 次回からは5章。いよいよ化学反応について考えていきます。解説 質量パーセント濃度 = 溶質(g) 溶液(g) ×100より 250 ×100=8 (2)答 250g % 解説 ① 砂糖水(溶液) = 砂糖(溶質)水(溶媒) より 500=250 ② 質量パーセント濃度 = 溶質(g) 溶液(g) ×100より 50 250 ×100= (3)答375%ア) 5g イ) 15g ウ) 25g エ) 35g 実験2の①で、物質Cの水溶液の質量パーセント濃度を、図から読み取った値をもとに計算し、小数第1位を四捨五入して求めよ。 実験2の②ようにして結晶を取り出す操作のことを何というか。

見にくくてすいません 化学の質量パーセント濃度計算で Clear
パーセント 濃度 希釈 計算
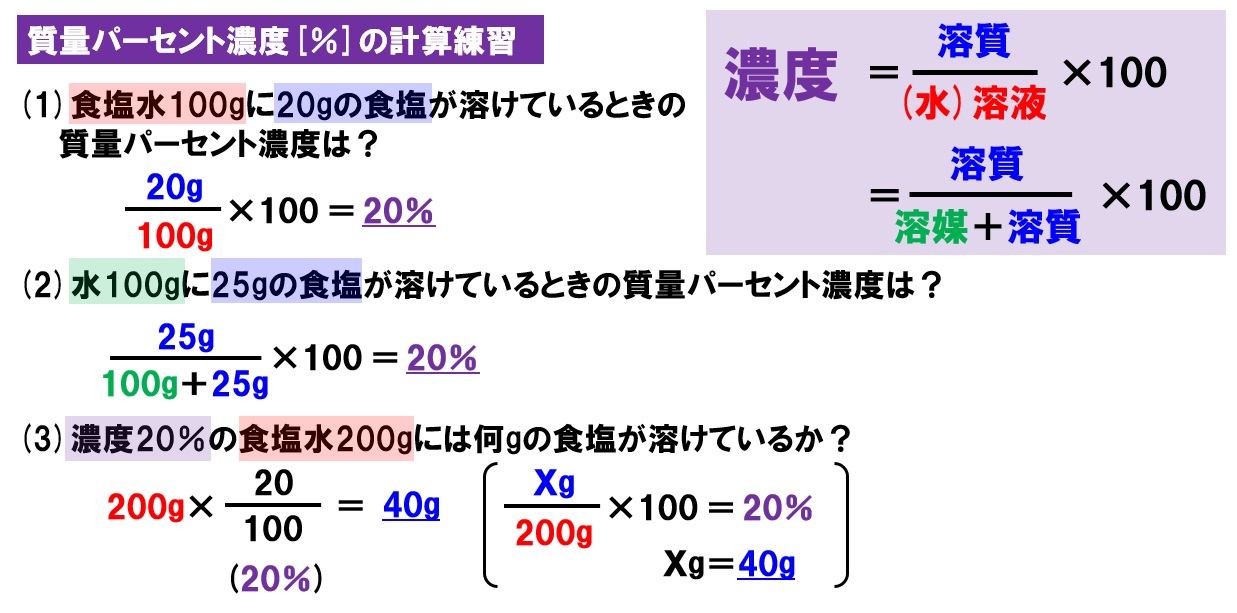
パーセント 濃度 希釈 計算- 質量パーセント濃度(%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)×100 これは、溶液の中に溶けている溶質が全体の何パーセントかということです。(2) 重量パーセント濃度% 溶液の重量の100に対する溶質の重量を表したもの(100分の1濃度) 《例題》 1)水100gにNaClを25g溶かしたときの重量%濃度は? (答え) % 2)5%の食塩水0g中に含まれる食塩は何g? (答え) 10g
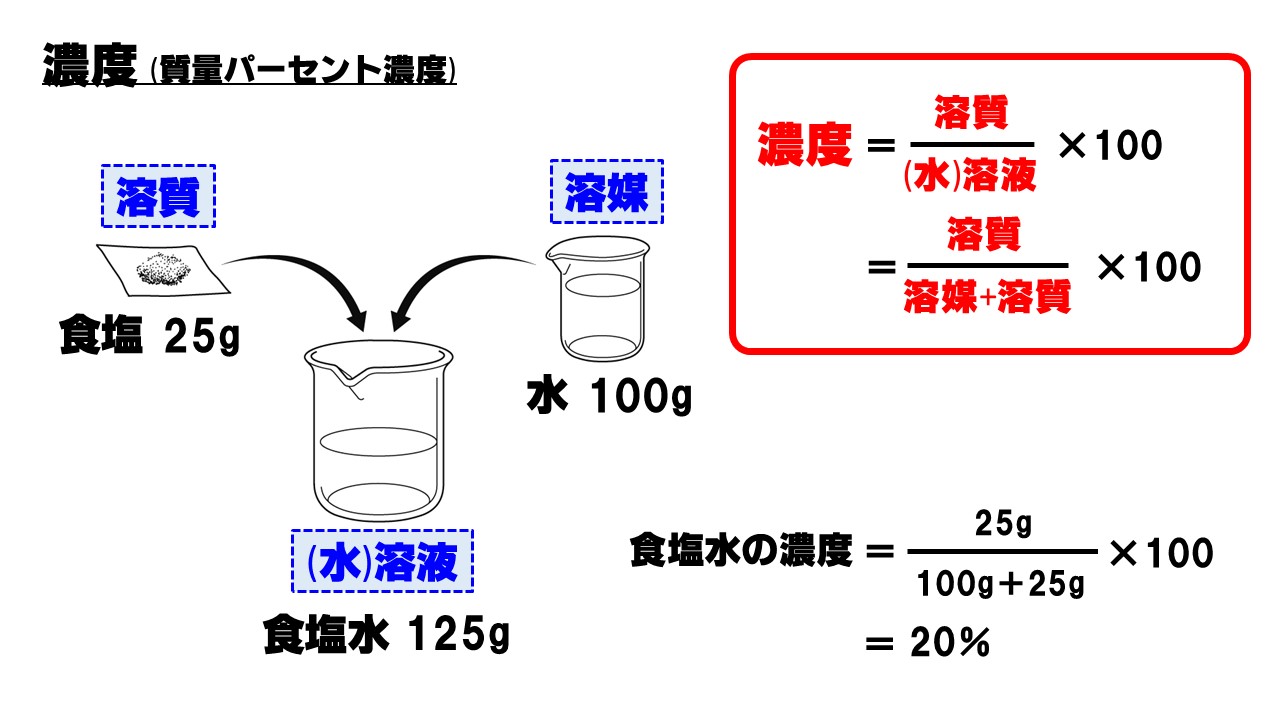



中1理科 濃度 質量パーセント濃度 のポイント Examee
パーセント(%)& パーセンテージの出し方(簡単な計算方法)数字や計算があると、ついつい難しく考えてしまいがちですよね。誰でも簡単に分かりますので、ご安心下さいませ!・メインの物 ÷ 計算したい物 x 100 = パーセント(%)の計算ができます。 精油濃度10%《以上》のブレンドは、全体の容量に精油を《含めて》計算する。 実際のレッスンでは、 計算が苦手な人でも、お皿洗いをしながらでもパパッと暗算できる 精油濃度計算の裏技などもあわせてご紹介しています。もともと数字が苦手だった私消毒薬の希釈液の作り方 消毒薬の使用において,期待する殺菌効果を得るためには使用濃度を正確に守る必要がある。 しかし消毒薬にはいろいろな濃度のものがあり,使用濃度に希釈して用いる時に混乱することが多い。 一般にA%の消毒薬を希釈してB
質量パーセント濃度 をどのように求めるかというと、次の式に当てはめます。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g〕)×100計算式 必要な原液量(mL)=希釈液の濃度(%) / 原液の濃度(%) × 作成する希釈液の量(mL) 必要な原液量(mL)=作成する希釈液の量(mL) / 希釈液の倍率 ※計算結果や情報等に関して当サイトは一切責任を負いません。また個別相談は対応しません。理科計算ドリル(平成28年度版) 教育出版 ホーム > 教科書・教材 > 中学校 > 理科 > 学習資料・指導資料 > 教師向け指導資料 > 理科計算ドリル(平成28年度版)
さあ、ここから計算のコツ、行きますよ! 先ほどの濃度を求める式に、 具体的な言葉(=しお)を入れると、 楽な書き方になるんです。 質量パーセント濃度(%) しお (g) しお水 (g) しお(g) しお(g)+水(g)濃度計算 質量パーセント濃度を求めよ。(割り切れない場合は小数第1位を四捨五入して整数で答えよ) 0gの水溶液の中に、溶質が30gが溶けている場合。 水460gに溶質40gを溶かした水溶液。 150gの水溶液のうち、100gが溶媒の場合。 次の問いに答えよ。動画一覧や問題のプリントアウトはこちらをご利用ください。ホームページ → http//19chtv/ Twitter→ https//twittercom/haichi_toaru
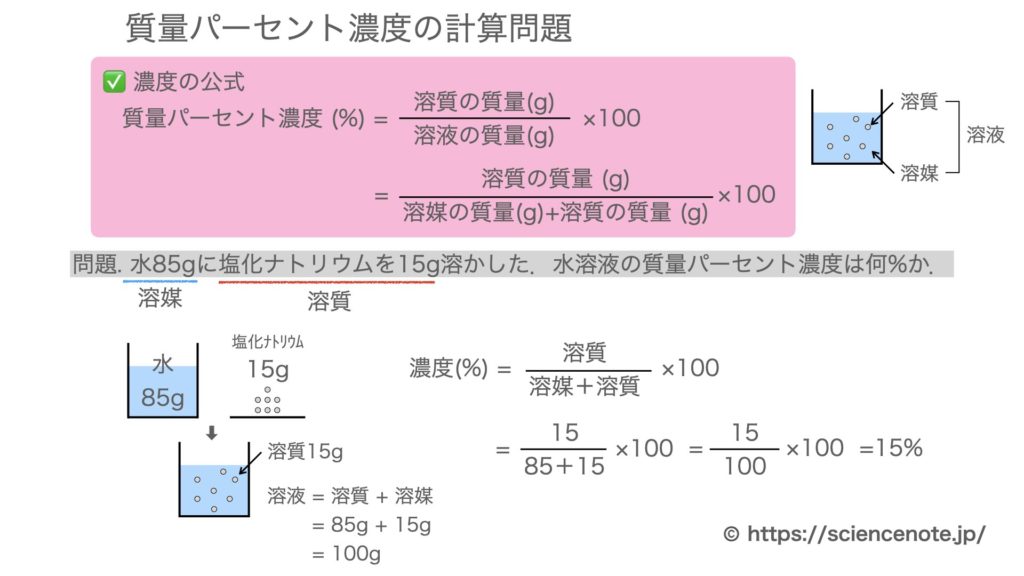



水溶液と質量パーセント濃度の計算問題 Hiromaru Note



Search Q E8 E9 87 8f 91 E6 Bf E5 Ba A6 Ab E6 Bf E5 Ba A6 Tbm Isch
質量パーセント濃度 計算問題 次の問いに答えよ。 (1) 砂糖水250gがある。この中に砂糖がg溶けている場合、この砂糖水の質量パーセント濃度は何%か。 (2) 0gの水に、砂糖を50g溶かした。 このときできた砂糖水は何gか 硝酸の質量パーセント濃度をモル濃度濃度を にするには 薬品を g (グラム) mg (ミリグラム) ml (ミリリットル) cc (シーシー) l (リットル) kg (キログラム) m3 (立方メートル) いれる。 使い方 数値を入れて、計算ボタンを押します。第9回物質科学 濃度計算 H=10,C=12,N=14,O=16,Na=23,S=32,Cl=355, Ca=40 質量パーセント濃度 1 15% NaCl 水溶液100 g つくるには、NaCl は何g 必要か。




重量パーセント 溶液の濃度を示す3つのパーセント Tbtky




モノマナビ研究所
質量パーセント濃度の計算問題集基本編 科学者たちは、質量パーセント濃度という基準をつくり、世界を発展させたことは学びましたよね。 具体的にいえば、 「この溶液が100gあったとき、溶質は何gあるのか? 」 を示す指標です。 質量 濃度の単位を計算する方法 溶液中の溶質と溶媒を特定したら、その濃度を決定する準備が整います。 濃度は、使用、いくつかの異なる方法で表現することができる質量%の組成物を、体積パーセント、モル分率、モル濃度、モル濃度、または正常。 比容積パーセント濃度に作られた溶液は、通常、メスフラスコを使用して調製されます。 ボリュームパーセントはいつ使用されますか? 純粋な液体溶液を混合して溶液を調製する場合は常に、体積パーセント(vol / vol%またはv / v%)を使用する必要があり




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月




中1理科 濃度 質量パーセント濃度 のポイント Examee
W/w% は,質量パーセント濃度,若しくは重量パーセント濃度という。溶液も溶質も質量gの場合であり,w/w% のほかwt% やmass%という表し方もある。単に% の場合は,こ れを指す場合が多い。w/w% = 溶質の質量×100 で表す。質量/体積(容積)パーセント濃度の求め方 溶質の質量 (g) ÷ 溶液の体積・容積 (ml) × 100 = 質量/体積パーセント濃度 %重量を濃度に、また、濃度を重量に変換する場合の換算係数を示します。 ミリオスモル(mOsm/L) mOsm/L 溶液1L中に溶けている粒子の数




理科 中1 27 質量パーセント濃度 Youtube




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット
7:数は、パーセントをつけて表すこともできる → 左は005 = 5%、右は0048→ 48% → パーセントは単位ではない、桁をあげる接尾語(正しくは下表参照) → パーセントを使って表した濃度を、パーセント濃度、というこのときに使うのは、質量パーセント濃度です。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/水溶液の質量〔g〕)×100 (1)水酸化ナトリウムの質量パーセント濃度をモル濃度に変換します。 0 % 以上 522 % 以下の誤差(標準偏差)は ± mol/L です。 質量パーセント濃度




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




B 2 Q37 2 P45right 1 Descubre Como Resolverlo En Qanda
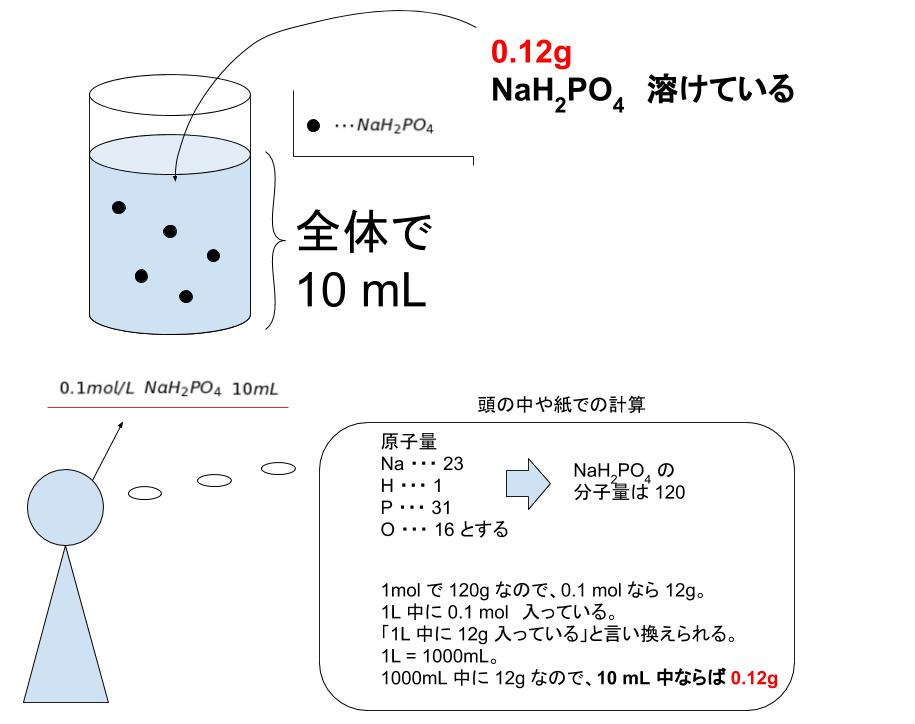



溶液の濃度計算 薬学 これでok




質量パーセント濃度 塾の質問箱




Akiya Su En Twitter 理科 質量パーセント濃度 溶質 溶媒 溶液と公式を覚えること 計算は難しくないが 割り算の筆算で小数点の位置がわからない人は先生に聞こう 中学理科 質量パーセント濃度
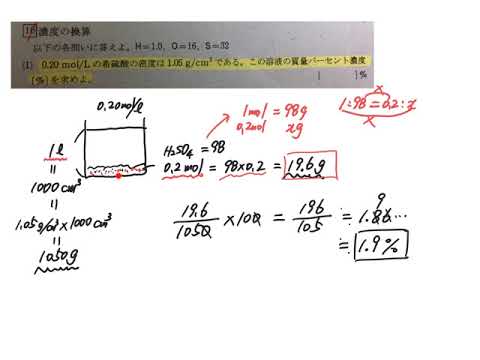



化学 Mol濃度 質量パーセント濃度 Youtube




高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット




見にくくてすいません 化学の質量パーセント濃度計算で Clear




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




中1 理科 中1 質量パーセント濃度 問題 中学生 理科のノート Clear



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ




中学理科 計算問題 質量パーセント濃度の計算 Youtube




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン
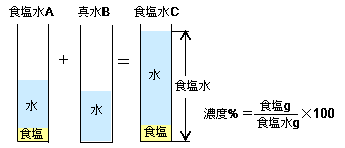



濃度算 薄める 高精度計算サイト




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度の計算問題集 応用編 Menon Network




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット




Akiya Su 理科 質量パーセント濃度 溶質 溶媒 溶液と公式を覚えること 計算は難しくないが 割り算の筆算で小数点の位置がわからない人は先生に聞こう 中学理科 質量パーセント濃度




中学理科 計算問題 質量パーセント濃度の計算 Youtube




高校生 質量パーセント濃度のノート一覧 Clear
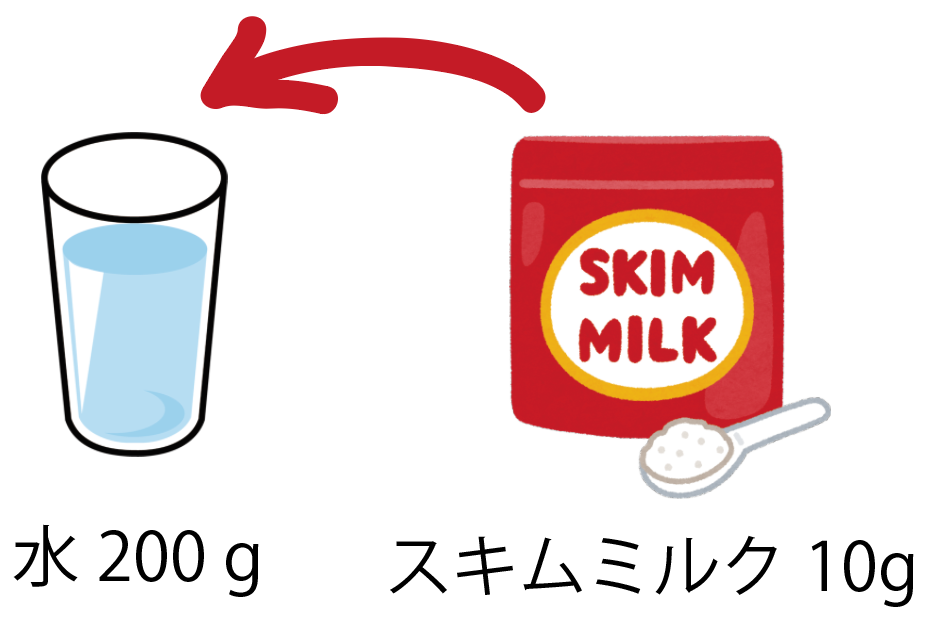



これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



濃度の応用




危険物資格取得のための高校化学no 1 濃度計算 F M サイエンスブログ




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン




質量パーセント濃度の計算問題集 基本編 Menon Network




質量パーセント濃度の計算問題集 応用編 Menon Network
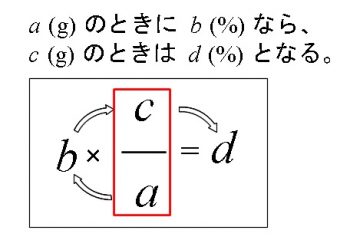



溶液の質量パーセント濃度の求め方と比重を利用した計算問題




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度の計算問題集 応用編 Menon Network




中1 理科 中1 32 質量パーセント濃度 Youtube




質量パーセント濃度の計算問題集 基本編 Menon Network



1
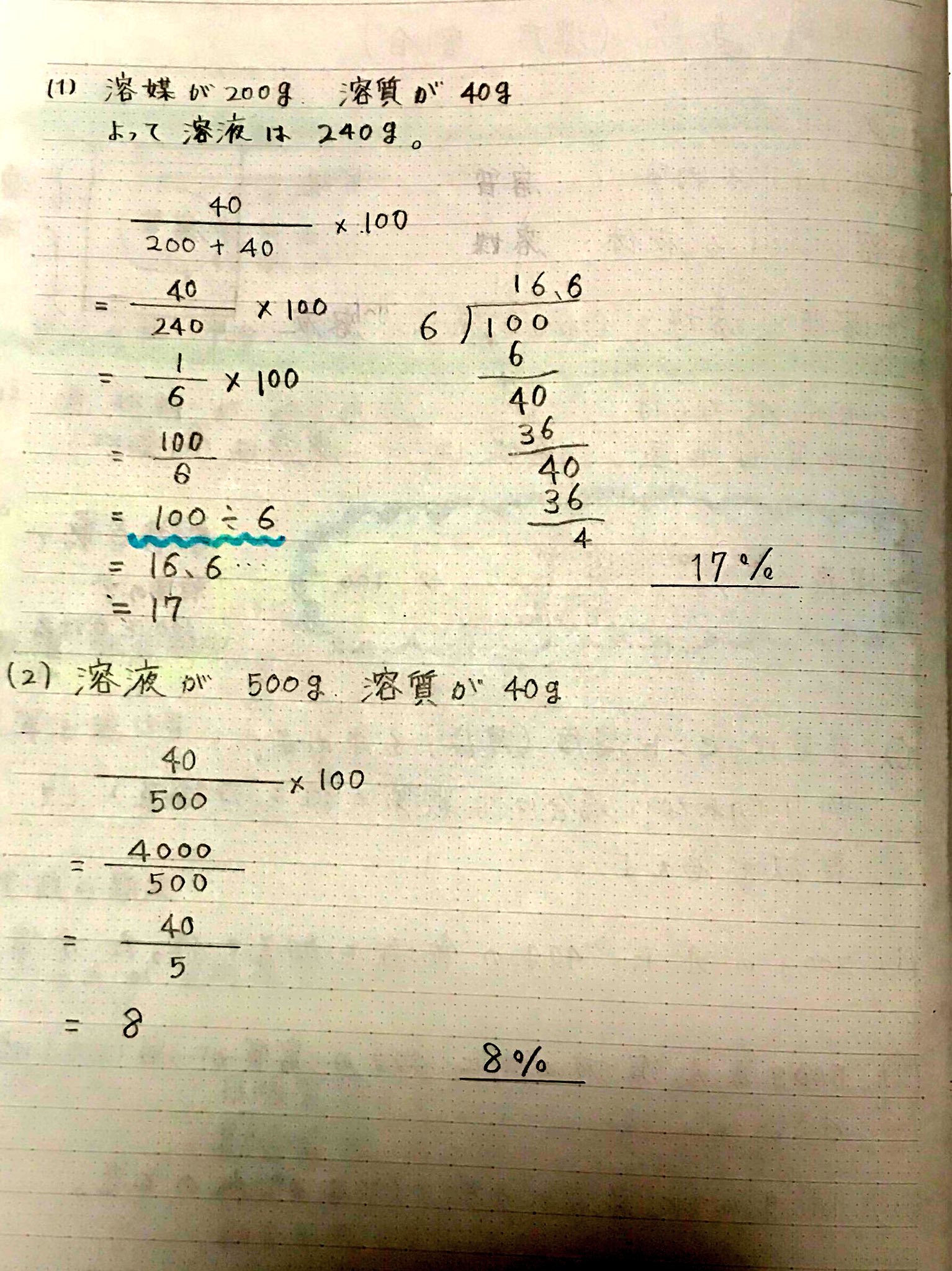



Akiya Su 理科 質量パーセント濃度 溶質 溶媒 溶液と公式を覚えること 計算は難しくないが 割り算の筆算で小数点の位置がわからない人は先生に聞こう 中学理科 質量パーセント濃度



基礎化学3 溶液




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




モル計算 濃度計算などの問題 解説 レベルa2 ともよし塾 受験と科学の解説授業




質量パーセント濃度の計算問題集 基本編 Menon Network




化学基礎です 答えを教えてください Clear



質量パーセント濃度中1です 理科の質量パーセント濃度が解けませ Yahoo 知恵袋
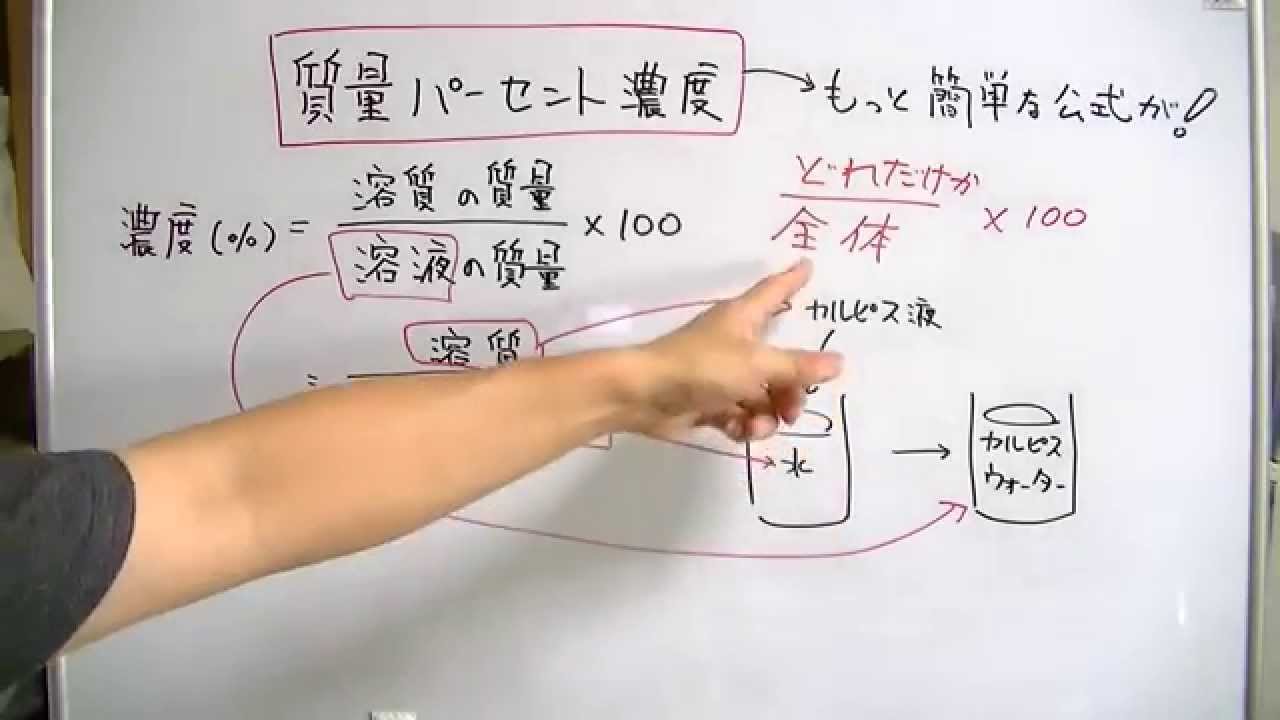



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube
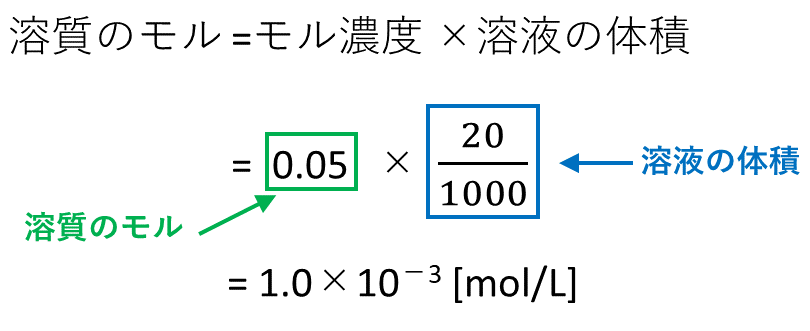



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




質量パーセント濃度の計算問題集 基本編 Menon Network




質量パーセント濃度に関する問題です 0 4がどこから出てきたのかわかりません Clear
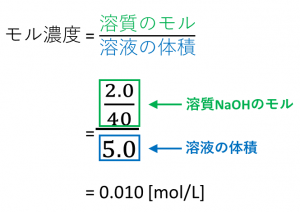



質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com
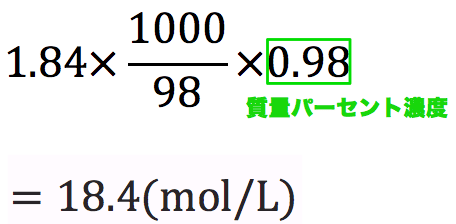



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




化学 濃度の計算 オンライン無料塾 ターンナップ



基礎化学3 溶液
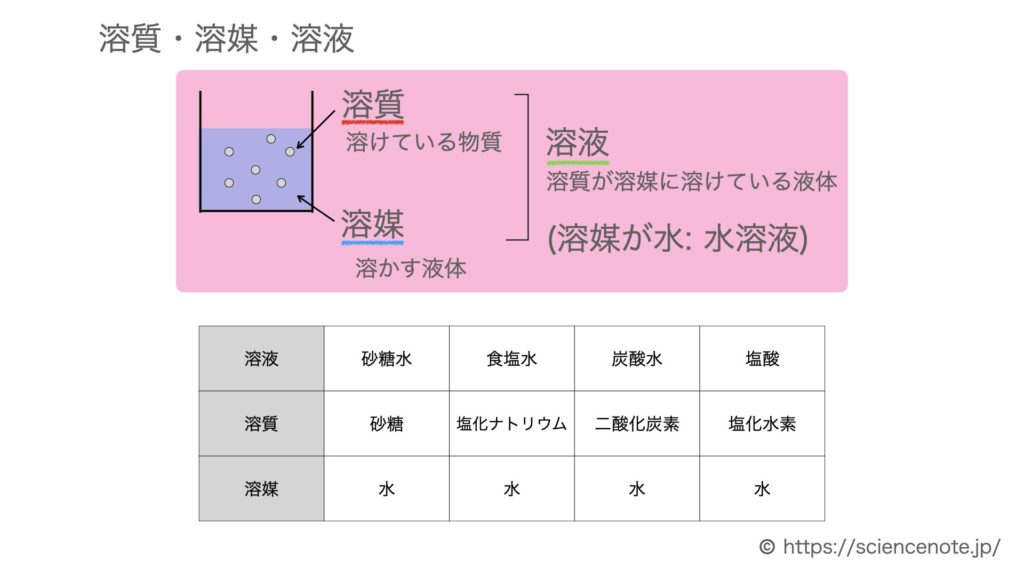



水溶液と質量パーセント濃度の計算問題 Hiromaru Note




質量パーセント濃度の計算問題集 応用編 Menon Network




1 30g 3100g Descubre Como Resolverlo En Qanda




化学勉強法 センター試験09 Mol濃度から質量パーセント濃度へ 大村の化学勉強法




質量パーセント濃度の計算問題集 応用編 Menon Network




質量パーセント濃度の計算問題集 基本編 Menon Network
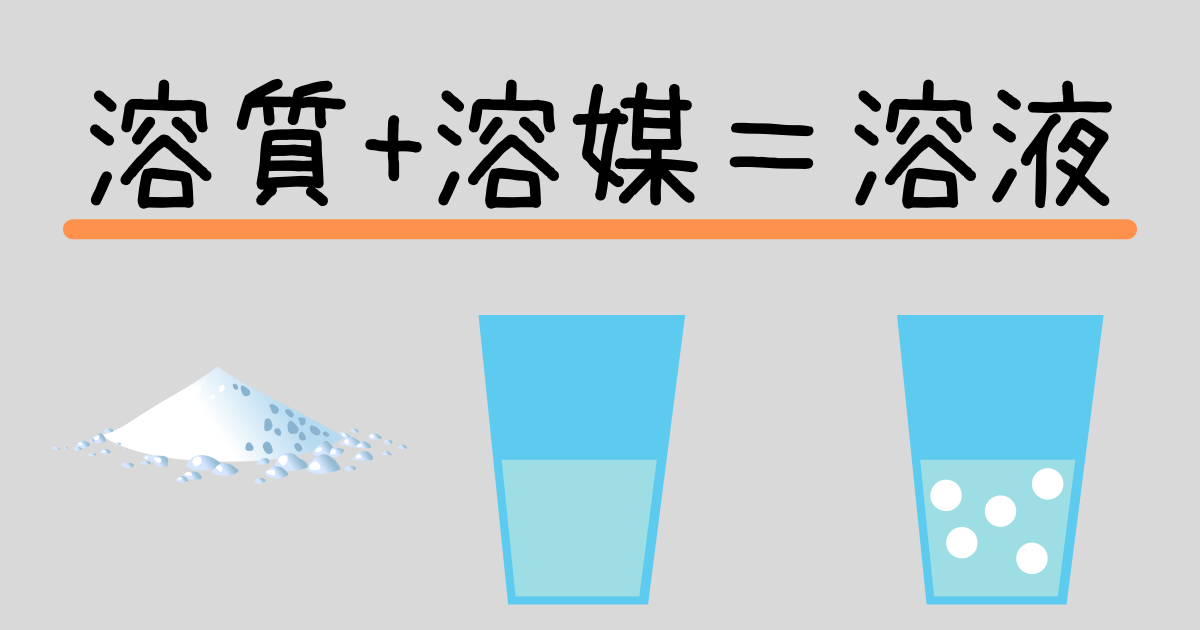



水溶液と質量パーセント濃度の計算問題 Hiromaru Note




質量パーセント濃度の求め方とモル濃度の違い



中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋




4 6 溶液の濃度 おのれー Note
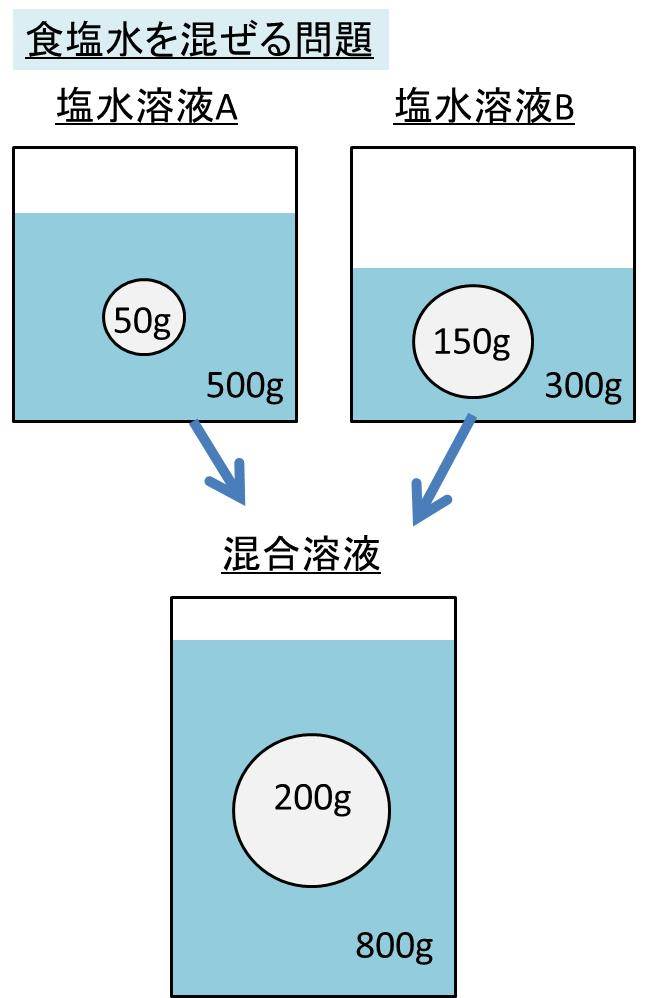



Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算
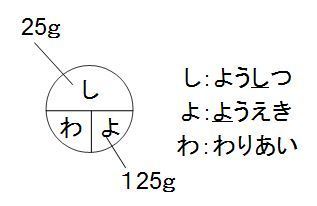



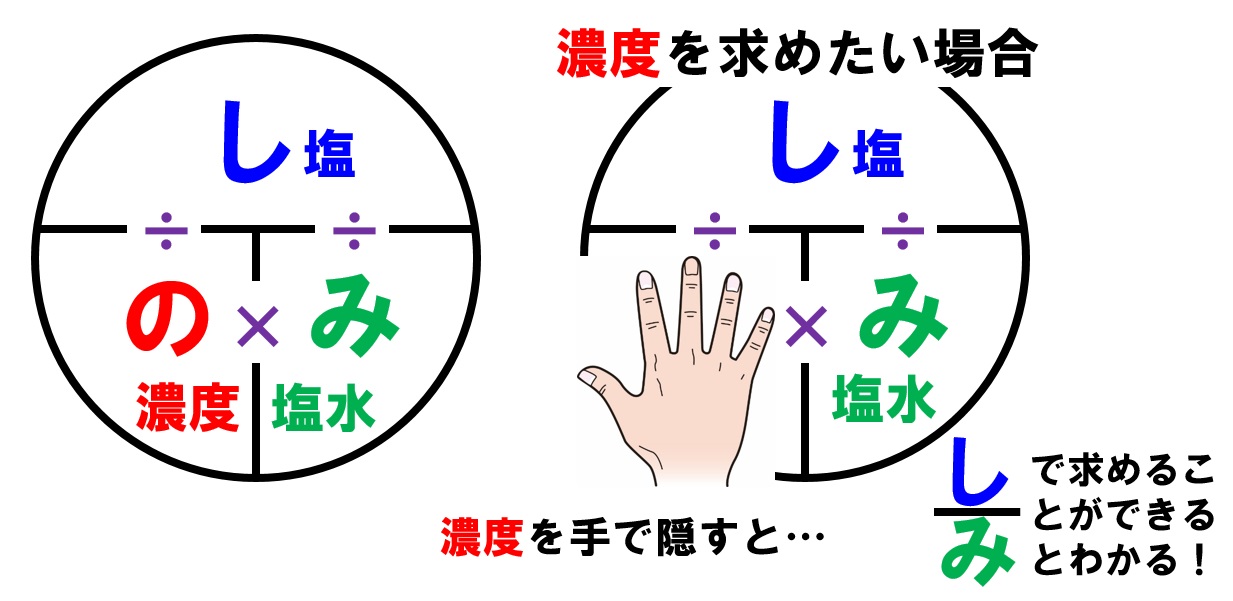
しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート




濃度について 質量パーセント W W と質量体積パーセント W v 生涯学人 まなびと 楽しいサイエンス 暮らしはサイエンス 子供たち サイエンスを感じて



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com
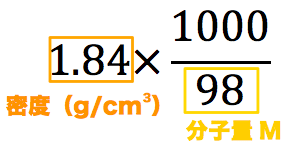



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




質量パーセント濃度の計算問題集 基本編 Menon Network




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度の計算問題集 基本編 Menon Network




4 6 溶液の濃度 おのれー Note



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




質量パーセント濃度の問題を計算したのですが どうやっても答えになり 中学校 教えて Goo



重量パーセント濃度について オフィス 宮島の理科一問一答 Welcome To Office Miyajima Web Site




Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee
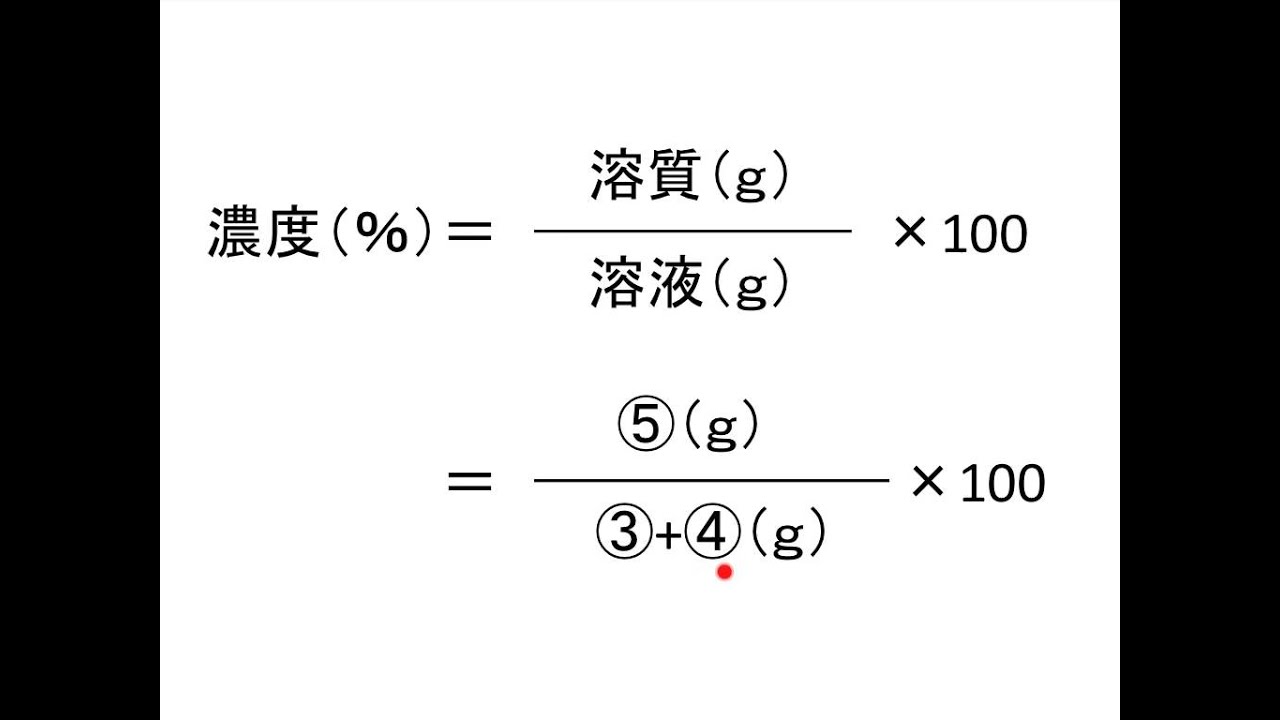



濃度の求め方 絵で覚えよう Youtube



Thinkstock Images



1




質量パーセント濃度の計算問題集 応用編 Menon Network




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




6 50b B Descubre Como Resolverlo En Qanda
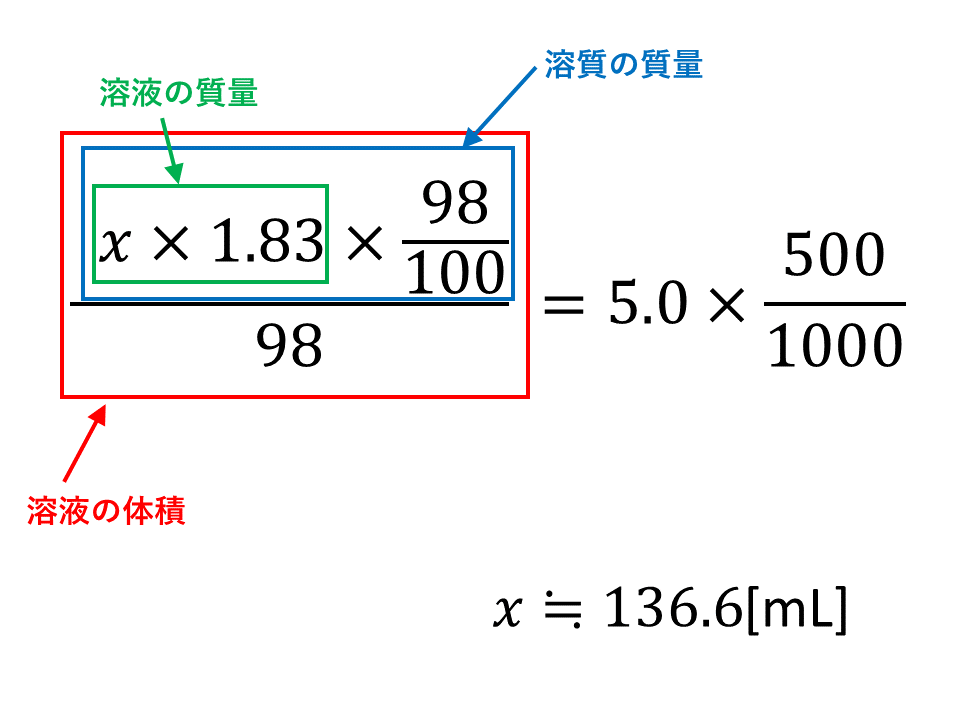



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




溶液の質量パーセント濃度の求め方と比重を利用した計算問題




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット



公式を使う
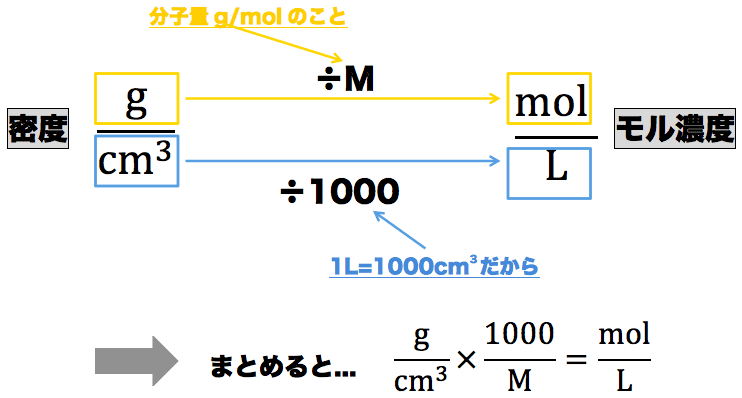



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




0g Descubre Como Resolverlo En Qanda




密度や質量パーセント濃度の計算の 覚え方を教えてください Clear




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



1




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




質量パーセント濃度 中学生 理科のノート Clear




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく


